Rohstoffenthalpie grobkeramischer Rohstoffe (Teil 1)
Die Rohstoffenthalpie dHR hat einen wesentlichen Einfluss auf die energetische Bilanzierung von Tunnelöfen in der grobkeramischen Industrie und kann bis zu 30 % des gesamten Energieverbrauchs eines Ofens betragen bzw. bis zu 90 % des gesamten Energiebedarfs decken. Derzeit werden unterschiedliche Methoden genutzt, um die Rohstoffenthalpie zu ermitteln. Bei Tonrohstoffen, die keine Carbonate bzw. organische Bestandteile enthalten, stimmen gemessene und berechnete Werte mit Abweichungen von maximal ±100 kJ/kg vergleichsweise gut überein. Liegen jedoch Rohstoffe mit hohen Carbonat- und Organikgehalten vor, unterscheiden sich die Ergebnisse der unterschiedlichen Bestimmungsmethoden erheblich voneinander. Bisher ist nicht bekannt, welche Bestimmungsmethode tatsächlich praxisrelevante Werte liefert. Inhalt des Beitrages sind vergleichende Untersuchungen zur Rohstoffenthalpie an bekannten Rohstoffen. Die unterschiedlichen Bestimmungsmethoden (Dynamische Differenzkalorimetrie, Thermogravimetrie, Kalorimeter, Berechnung aus dem Mineralbestand sowie aus den Gehalten an Wasser, Carbonaten und organischen Bestandteilen) werden vorgestellt und anhand der Ergebnisse Unterschiede, mögliche Einsatzgrenzen und Fehlerquellen der Methoden diskutiert.
1 Einleitung
Energieeinsparungen und damit verbundene Kostensenkungen sind ein Hauptthema in der Ziegelindustrie. Es ist bekannt, dass die Enthalpie der zu brennenden grobkeramischen Rohmaterialien einen wesentlichen Einfluss auf den Energieverbrauch eines Tunnelofens hat, insbesondere wenn die Rohmaterialien Wasser, Carbonate bzw. organische Bestandteile wie Holz, Fangstoffe, Bitumen oder Kohle enthalten.
Folgende Extrembeispiele zeigen den Anteil, den die Wärme-verbrauchenden (endotherm, positiver Wert) und Wärme-freisetzenden (exotherm, negativer Wert) Rohstoffenthalpien am Energieverbrauch von herkömmlichen Tunnelöfen im Bereich der Grobkeramik maximal haben können (vgl. [1–2]):
Für Hintermauerziegel (HMz) nimmt die Rohstoffenthalpie Werte zwischen +600 kJ/kg (endotherm) und ‑1.000 kJ/kg (exotherm) an. Bei einem spezifischen Energieverbrauch von 1.100 bis 1.800 kJ/kg für HMz entspricht das bis zu ca. 90 % des Brennstoffeinsatzes eines Tunnelofens.
Für Vormauerziegel (VMz) und Klinker nimmt die Rohstoffenthalpie Werte zwischen +600 kJ/kg (endotherm) und -300 kJ/kg (exotherm) an. Bei einem spezifischen Energieverbrauch von 1.800 kJ/kg bis 2.600 kJ/kg für VMz und Klinker entspricht das bis zu ca. 30 % des Brennstoffeinsatzes eines Tunnelofens.
Die Wärme-verbrauchenden und -freisetzenden Reaktionen grobkeramischer Rohstoffe treten bekanntlich bei unterschiedlichen Temperaturen auf. Sie können abhängig von der Materialzusammensetzung, der Aufheizgeschwindigkeit, dem Ziegelformat, dem Besatzaufbau und damit den Wärmeübergangsmechanismen sowie der Ziegelmasse sowohl zeitlich nacheinander als auch überlagert ablaufen (vgl. [3–5]). Daher finden die Reaktionen beim Brennen an verschiedenen Positionen im Tunnelofen statt. Der Ofen und dessen Prozessführung werden vom Anlagenbauer auf den jeweiligen Rohstoff abgestimmt, um Leistungs- und Qualitätsminderungen zu vermeiden. Neben der zum Aufheizen erforderlichen Energie muss die Brenneranlage zusätzlich die Wärme-verbrauchende Rohstoffenthalpie aufbringen. Abhängig von der Art und Menge der organischen Bestandteile kann jedoch nicht die gesamte freiwerdende Wärme im Ofen genutzt werden. Je nach Reaktionstemperatur der organischen Bestandteile wird die entstehende Wärme zum Teil mit den Rauchgasen freigesetzt.
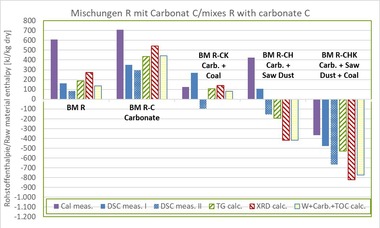
Für die Bestimmung der für die Anlagenauslegung erforderlichen Rohstoffenthalpie kommen nach wie vor unterschiedliche Methoden zum Einsatz. Die Erfahrungen der letzten Jahrzehnte im Lingl-Labor haben gezeigt, dass insbesondere bei der Anwesenheit von Carbonaten und organischen Bestandteilen die Ergebnisse der unterschiedlichen Methoden um ein bis zwei Größenordnungen voneinander abweichen (vgl. »1 und »2) [6].
Für den Anlagenbauer liegt die Bedeutung dieses Themas im zunehmend an Vertragsstrafen gekoppelten Energieverbrauch der Tunnelöfen. Dies führte in der Vergangenheit bis hin zu gutachterlichen Auseinandersetzungen zwischen Kunden und Anlagenbauer infolge der Anwendung unterschiedlicher Bestimmungsmethoden und dem damit begrenzt möglichen Vergleich der Messergebnisse. Immerhin muss der Ofenbetreiber bei einem Energiemehrverbrauch von beispielsweise +100 kJ/kg Rohstoffenthalpie, einer Produktionsleistung von 200.000 t pro Jahr und einem Gaspreis von 27,35 € je MWh zusätzliche Energiekosten von rund 160.000 € pro Jahr aufbringen (Gaspreis aus [7]).
Aus diesem Grund wurden systematische Laboruntersuchungen mit den bisher angewandten Bestimmungsmethoden an definierten Massen durchgeführt und mit dem Kalorimeter eine weitere Messmethode einbezogen. Ziel der Untersuchungen war es, die Messergebnisse gegenüberzustellen sowie deren Fehler- und Anwendungsgrenzen zu bewerten. Die Untersuchungen wurden im Rahmen einer Masterarbeit im Studiengang „Ceramic Science and Engineerging“ der Hochschule Koblenz / Universität Koblenz Landau (vgl. [8]) durchgeführt und ermöglicht von der Lingl Anlagenbau GmbH, wofür an dieser Stelle besonders gedankt wird.
2 Grundlagen und Methodik
Beim Brennen wird das Brenngut entsprechend einer vorgegebenen Brennkurve mit Wärme behandelt. Die dafür erforderliche thermische Energie setzt sich aus zwei Termen zusammen (Gleichung 1):
Erwärmung des Brenngutes auf die entsprechende Temperatur und
Enthalpie aus den physikalischen und chemischen Reaktionen im Material.
qG = cp * dT + dHR⇥(1)
qG zur Wärmebehandlung des Brenngutes erforderliche spezifische Wärmemenge in kJ/kg
cp mittlere spezifische Wärmekapazität des Brenngutes als Funktion der Temperatur in kJ/kgK
dT Differenz aus maximaler Brenntemperatur und Einfahrtemperatur des Brenngutes in °C
dHR (Rohstoff)-Enthalpie der physikalischen und chemischen Reaktionen im Material in kJ/kg
Grobkeramische Rohstoffe verändern während des Brennens ihre Struktur unter Bildung amorpher und kristalliner Silicatphasen. Dabei setzen sie hauptsächlich die Gase Wasserdampf (H2O), Kohlenstoffdioxid (CO2) und Schwefeldioxid (SO2) frei. Die unterschiedlichen Reaktionen können Wärme verbrauchen oder abgeben (vgl. »Tabelle 1). Durch Addition der temperaturabhängigen Reaktionswärmen der einzelnen Minerale ergibt sich die sogenannte Rohstoffenthalpie, die dem Heizwert Hu von Brennstoffen entspricht (vgl. Punkt 2.3). Die Rohstoffenthalpie bezieht sich auf die jeweilige Trockenmasse des Materials.
Zum Erwärmen und Verdampfen der physikalisch gebundenen Materialfeuchte (Adsorptionsfeuchte und Wasser zur Formgebung) wird zusätzlich Energie benötigt. Diese beträgt bei 25 °C +2.442 kJ/kg Wasser, d. h. +185 kJ/kg zum Erwärmen von 25 °C auf 100 °C und +2.257 kJ/kg zum Verdampfen bei 100 °C.
Zur Bestimmung der Rohstoffenthalpie grobkeramischer Rohstoffe werden derzeit folgende Methoden eingesetzt:
Messen:
mit dynamischer Differenzkalorimetrie -> Institute, universitäre Einrichtungen und Industrielabore
mit Bomben-Kalorimeter -> v. a. Institute für Brennstoffe u. a. grobkeramische Rohstoffe
Berechnen:
aus Mineralbestand, bestimmt mittels Röntgenbeugung und Simultanthermoanalyse -> grobkeramische Institute und Anlagenbauer
aus Masseverlust der Thermogravimetrie sowie aus Erfahrungswerten der differentiellen Thermoanalyse (DTA) bzw. der dynamischen Differenzkalorimetrie (DSC) -> auf grobkeramische Rohstoffe spezialisierte Institute
Bei allen Methoden ist es erforderlich, die Probemenge so klein wie möglich, jedoch so groß wie notwendig zu wählen. Einerseits führen bei der Thermoanalyse kleine Probemengen und übliche Heizraten zu auswertbaren Messergebnissen. Andererseits muss die Probemenge so groß gewählt werden, dass die Probe auch bei groben Einschlüssen für das Material repräsentativ ist.
Für eine ausführliche Beschreibung der Messmethoden wird auf die jeweilige Norm bzw. Literatur verwiesen. Die folgenden Punkte beschreiben das Wesentliche der Methoden.
2.1 Dynamische Differenzkalorimetrie DSC
Bei der DSC (engl. differential scanning calorimetry) werden die auf eine Korngröße kleiner 100 µm zerkleinerte Probe und ein thermisch inertes Material gleichzeitig in jeweils einem Tiegel entsprechend einem vorgegebenen Temperaturprogramm aufgeheizt. Die in der Probe ablaufenden chemischen und physikalischen Reaktionen (vgl. »Tabelle 1) führen zu einer Abgabe oder Aufnahme von Wärme und damit zu einer Temperaturdifferenz zwischen der Probe und dem inerten Material. Diese Temperaturdifferenzen sind als Peak in der Wärmestromkurve zu sehen [9–11].
Die Kalibrierung des Messgerätes mit kalorisch definierten Substanzen ermöglicht es, aus den Peakflächen der Wärmestromkurve kalorische Werte für die jeweiligen Reaktionen zu berechnen. Zur Flächenberechnung wird eine Basislinie festgelegt. Für chemische Reaktionen und Phasenumwandlungen, bei denen sich die Wärmekapazität der Probe ändert, sollte die Korrektur der Basislinie mit Wendepunkt erfolgen [10]. Zudem sind Beginn und Ende einer Reaktion festzulegen. Um die Reaktionen voneinander abzugrenzen, werden die zeitgleich gemessene TG-Kurve sowie diverse Softwaretools genutzt. Beides erfordert viel Erfahrung – sowohl mit den zu messenden Materialien als auch mit der verwendeten Auswertungs-Software.
Die Temperaturen, bei denen die Reaktionen stattfinden und die Peakhöhe sind von der Probenpräparation (Korngröße, Verdichtung im Tiegel), der Probenmasse und der Aufheizrate abhängig. Die thermischen Reaktionen grobkeramischer Rohstoffe werden üblicherweise mit einer Probenmasse zwischen 30 und 50 mg in Platintiegeln bis 1.050 °C bestimmt. Die Aufheizraten betragen 2 bis 20 K/min. Lehnhäuser empfiehlt für grobkeramische Rohstoffe eine Probemasse von 100 bis 500 mg [11].
2.2 Thermogravimetrie TG
Bei der Thermogravimetrie wird die Probe in einem Tiegel entsprechend einem vorgegebenen Temperaturprogramm aufgeheizt. Dabei werden die Probenmasse bzw. die Masseänderung in Abhängigkeit der Temperatur bestimmt [12].
»Tabelle 1 zeigt die wesentlichen Wärme-verbrauchenden und -freisetzenden Reaktionen grobkeramischer Rohstoffe in den unterschiedlichen Temperaturbereichen. Durch die entstehenden Gase tritt ein Masseverlust auf. Mit Hilfe der differentiellen TG-Kurve (DTG) wird dieser genauer eingegrenzt und für die jeweilige Reaktion angegeben. Die Ermittlung der einzelnen Masseverluste erfordert die Aufnahme einer Auftriebskurve für die entsprechenden Messbedingungen.
Die rechte Spalte der Tabelle enthält die Faktoren, mit denen die Rohstoffenthalpie aus dem Masseverlust im entsprechenden Temperaturbereich berechnet werden kann. Diese Faktoren sind Erfahrungswerte aus vergleichenden Messungen der Simultanthermoanalyse von TG und DTA bzw. DSC der vergangenen Jahrzehnte [13].
2.3 Kalorimeter, Brennwert und Heizwert
Das adiabate Bombenkalorimeter wurde zur Bestimmung des Brennwertes von Brennstoffen entwickelt. Es besteht aus einem inneren, wassergefüllten Kalorimetergefäß mit Thermoelement und Rührwerk sowie einem äußeren, beheizbaren Wassermantel. Die Probe wird in einem Tiegel eingewogen und dieser samt Zünddraht und Verbrennungshilfsmitteln im Kalorimetergefäß eingehängt. Nach dem Verschließen wird die Bombe mit Sauerstoff auf einen Druck von 30 bar gefüllt und damit die restliche Luft aus dem Gefäß herausgedrückt. Die Zündung erfolgt von außen durch den Zünddraht. Die bei der Verbrennung entstehende Wärme erhitzt das durch den Rührer umgewälzte Wasser im Kalorimetergefäß um wenige Kelvin. Ein Thermoelement mit hoher Auflösung misst diese Temperaturänderung. Durch gleichzeitiges Heizen bzw. Kühlen erfährt der Außenmantel einen entsprechenden Temperaturausgleich, sodass keine Wärme von innen abgegeben oder von außen aufgenommen wird (= adiabat) [14].
Die auf die Masse bezogene Wärmemenge, die Brennstoffe beim vollständigen Verbrennen freisetzen (exotherm), wird als Brennwert Ho bezeichnet. Dieser wird nach [15] im Bombenkalorimeter bei konstantem Volumen aus der gemessenen Temperaturänderung dT berechnet (Gleichung 2).
Ho = (CK * dT – QZ) / mP ⇥(2)
Ho Brennwert in J/g
CK Wärmekapazität des Kalorimetersystems in J/K
dT Temperaturerhöhung des Kalorimetersystems in K
QZ Wärmemengen aller Verbrennungshilfsmittel in J
mP Masse der Probe in g
Der Heizwert Hu wird aus dem Brennwert abzüglich der Kondensationswärme des Wassers im Rauchgas berechnet (vgl. Gleichung 3, für grobkeramische Rohstoffe vereinfacht unter Vernachlässigung der Volumenarbeit). Dieses Wasser kann sowohl aus der vorhandenen Brennstofffeuchte und den Hydroxyl-Gruppen (OH-Gruppen) wasserhaltiger Minerale stammen, als auch das Verbrennungsprodukt des in organischen Bestandteilen vorhandenen Wasserstoffs sein. Der Brennwert, d. h. die maximal nutzbare Wärmemenge eines Brennstoffes, ist durch die Addition der Kondensationswärme des Wassers stets größer als der Heizwert (vgl. Werte für Holz und Kohle, Tabelle 6).
Hu = Ho - [kH * H + 0,8 * (N + O) + kW * W]⇥(3)
Hu Heizwert in J/g
kH spezifische Verdampfungswärme des bei der Verbrennung aus dem Wasserstoff entstehenden Wassers mit +23,73 kJ je M.-% Wasserstoff (25 °C)
kW spezifische Verdampfungswärme von Wasser mit +24,42 kJ je M.-% Wasser (25 °C)
H Wasserstoffgehalt der Probe in M.-%
N Stickstoffgehalt der Probe in M.-%
O Sauerstoffgehalt der Probe in M.-%
W Wassergehalt der Probe in M.-%
Nach [15] sollte die Wiederholgrenze bei Einzelmessungen, einem Bediener und derselben Apparatur kleiner 120 kJ/kg sein. Die Bestimmungsgrenze liegt je nach Gerät zwischen 200 kJ/kg und 300 kJ/kg trockener Substanz (vgl. [15]). Die Einwaage von Probe und Verbrennungshilfsmittel muss so gewählt werden, dass der Temperaturanstieg im Kalorimeter ca. das 0,7-fache bis 1,3-fache des bei der Bestimmung der Wärmekapazität des Kalorimeters ermittelten Temperaturanstiegs beträgt. Da sich die Temperaturänderung des Wassers im Kalorimetergefäß infolge einer Verbrennung auf ca. 3 K bis 5 K beläuft, wird die Temperatur mit einer Genauigkeit von mindestens 0,004 K bestimmt [15, 17].
Die Rohstoffenthalpie grobkeramischer Rohstoffe ist im Vergleich zum Brennwert von Brennstoffen um das ca. 30-fache bis 500-fache kleiner. Aus diesem Grund wird die gering kalorische Rohstoffprobe zum Zünden und Aufheizen auf Brenntemperatur mit dem Mess-Standard Benzoesäure (Brennwert = -26.464 kJ/kg) im Masseverhältnis von 1,0 zu 1,4 gemischt [18].
2.4 Mineralbestand
Der Mineralbestand grobkeramischer Rohstoffe kann mit Hilfe röntgenographischer Untersuchungen (Röntgendiffraktometrie, engl. X-Ray Diffractometry XRD) sowie mithilfe der Thermoanalyse (DTA bzw. DSC, TG sowie Dilatometrie) ermittelt werden. Die quantitative Bestimmung der Tonminerale wird durch die Entwicklung hochempfindlicher Gerätetechnik und entsprechend vorhandener Kalibrierverfahren (Methode des äußeren Standards: Eichproben für einzelne Tonminerale) in spezialisierten Laboren seit Jahrzehnten praktiziert und ist in [19–21] beschrieben. Zur Erhöhung der Genauigkeit der XRD-Ergebnisse werden zusätzlich die Ergebnisse der Simultanthermoanalyse (gleichzeitige Bestimmung der DSC- und TG-Kurve) sowie der Dilatometrie genutzt.
Organische Bestandteile wie Holz, Kohle oder Papier (Fangstoffe) werden in Form von organischem Kohlenstoff (Total Organic Carbon – TOC) bzw. anorganischem Kohlenstoff (Total Inorganic Carbon – TIC) und als Gesamtkohlenstoff (Total Carbon – TC) während einer thermischen Behandlung mittels Infrarot-Spektroskopie extra bestimmt [22]. Nach [23] ergibt sich aus der Kenntnis der Reaktionswärmen der einzelnen Rohstoffkomponenten sowie deren Anteilen die resultierende Reaktionswärme entsprechend Gleichung 4 je kg trockenem Rohstoff.
dHR, tro = ∑ri * dHi⇥(4)
dHR, tro Rohstoffenthalpie, bezogen auf die Masse des trockenen
Rohstoffes in kJ/kg
ri Anteil der Rohstoffkomponente i, dimensionslos
dHi Reaktionswärme bei der Reaktion der Rohstoffkompo nente i in kJ/kg trocken
Die Rohstoffenthalpie des Brenngutes berechnet sich mit Hilfe des Glühverlustes nach Gleichung 5 je kg gebrannt.
dHR, gebr = dHR, tro / (1 – GV)⇥(5)
dHR, gebr Rohstoffenthalpie, bezogen auf die Masse des gebrannten Rohstoffes in kJ/kg
GV Glühverlust (als Summe aller flüchtigen Bestandteile, vgl. »Tabelle 1)
Neben der thermischen Zersetzung können sich neue Kristallphasen bilden. Die resultierende Reaktionswärme wird um die Reaktionswärme der Mineralphasenbildung ergänzt (Gleichung 6).
qRE = dHR, gebr + ∑rj * dHj ⇥(6)
qRE resultierende Reaktionswärme, bezogen auf die Masse des gebrannten Rohstoffes in kJ/kg
rj Anteil der neugebildeten Mineralphase j am gebrannten Gut, dimensionslos
dHj Reaktionswärme bei Bildung der Mineralphase j in kJ/kg
Voraussetzung zur Berechnung der Rohstoffenthalpie aus dem Mineralbestand ist die Kenntnis der Reaktionswärmen der einzelnen Rohstoffkomponenten. Der Satz von Hess dient der Berechnung von Enthalpieänderungen bei chemischen Reaktionen: „Die Enthalpieänderung dH eines Gesamtprozesses ist die Summe der Enthalpieänderungen der einzelnen Prozessschritte“. So kann auch die Rohstoffenthalpie eines Minerals aus der Summe der Bildungsenthalpien der Endprodukte abzüglich der Summe der Bildungsenthalpien der Ausgangsstoffe berechnet werden (Gleichung 7) [24].
dHi = ∑dH0B, E - ∑dH0B, A ⇥(7)
dHi Reaktionswärme bei der Reaktion der Rohstoffkomponente i in kJ/kg trocken
∑dH0B, E Summe der Standardbildungsenthalpien der Endprodukte einer chemischen Reaktion in kJ/mol
∑dH0B, A Summe der Standardbildungsenthalpien der Ausgangsstoffe einer chemischen Reaktion in kJ/mol
Voraussetzung für die Berechnung ist die Kenntnis der exakten chemischen Formeln, der Molmassen aller an der Reaktion beteiligten Stoffe und deren Standardbildungsenthalpien dHB sowie die Aufstellung der chemischen Reaktionsgleichung. Die chemischen Formeln, Reaktionsgleichungen und Bildungsenthalpien von Nichttonmineralen sind weitestgehend bekannt. Zu Tonmineralen als natürliche Verwitterungsprodukte finden sich in der Literatur hingegen wenige und teilweise widersprüchliche Angaben. Dies wird einerseits durch die Variabilität der Mineralzusammensetzung erschwert. Andererseits setzen sich die Tonminerale selten ideal zusammen bzw. kommen selten als einzelne Minerale vor.
»Tabelle 2 zeigt die aus der Literatur zusammengetragenen sowie die mit Gleichung 7 berechneten Rohstoffenthalpien für ausgewählte Minerale. Mit den Werten in der rechten Spalte wurden in diesem Beitrag die Rohstoffenthalpien aus der XRD berechnet. Sie sind anhand der Arbeiten von [20, 23, 25–29] festgelegt.
Die für reines Calcit und Dolomit angegebenen endothermen Werte sind für grobkeramische Rohstoffe zu groß, da in Tonen zusätzlich eine exotherme Bildung von Calcium-Silicaten oberhalb von 850 °C auftritt. Die Neubildungen der drei wesentlichen Calcium-Silicate setzen folgende Wärmen frei:
Wollastonit (CaO * SiO2) -715 bis -760 kJ/kg ⇥[23, 28, 30]
Gehlenit (2 CaO * Al2O3 * SiO2) -381 bis -500 kJ/kg ⇥[23, 28]
Anorthit (CaO * Al2O3 * 2 SiO2) -46 bis -344 kJ/kg ⇥[28]
Da sich erfahrungsgemäß beim Brennen carbonatreicher grobkeramischer Rohstoffe zwischen 40 und 70 % amorphe Phase und ungefähr 5 bis 20 % Calcium-Aluminium-Silicate bilden, erfolgte in diesem Beitrag eine Wertekorrektur für reines Calcit und Dolomit um jeweils -85 kJ/kg (exotherm). Dieser Wert resultiert aus eigenen Erfahrungen, wobei sich nach dem Brennen durchschnittlich 11 % Anorthit, 6 % Gehlenit, 3 % Wollastonit bilden. Es sei hier jedoch darauf hingewiesen, dass die Silicatbildung zunimmt, je größer die Brenntemperatur und je kleiner die Kühlgeschwindigkeit sind und je feiner das CaO vorliegt [23, 25, 30].
Die verschiedenen Werte für Pyrit resultieren aus den unterschiedlichen Reaktionsprodukten der Pyrit-Zersetzung zu SO2 oder SO3. Die Bildung von SO2 bzw. SO3 ist dabei druck- und temperaturabhängig. Die Werte der Tonminerale unterscheiden sich, da unterschiedliche Annahmen für die Wärmemenge der Wasserabspaltung zugrunde liegen [23, 27, 31]. Zudem hängt auch hier vom Brennregime ab, welche und wie viele Mineralphasen sich neu bilden (exotherme Reaktion) und somit bei den Berechnungen berücksichtigt werden sollten.
Eine weitere vereinfachte Methode zur Berechnung der Rohstoffenthalpie nutzt lediglich die drei wesentlichen, Wärme-verbrauchenden bzw. -freisetzenden Stoffe im Rohmaterial: das chemisch gebundene Wasser (OH-Gruppen), die Carbonate und den organischen Kohlenstoff (Gleichung 8).
dHR, tro = rW * dHR,W + rcarb * dHR,carb + rTOC * dHR,TOC⇥(8)
dHR, tro Rohstoffenthalpie, bezogen auf die Masse des trockenen Rohstoffes in kJ/kg
rW, Carb, TOC Anteile der Rohstoffkomponenten an chemisch gebundenem Wasser, Carbonat und TOC, dimensionslos
dHW, Carb, TOC Reaktionswärme bei der Reaktion der jeweiligen Komponente in kJ/kg trocken
Hilfe der TG können die Wasser- und Carbonatgehalte ermittelt werden. Der organische (TOC) und anorganische Kohlenstoffgehalt (TIC von Carbonaten) wird wie oben beschrieben bestimmt. In »Tabelle 2 sind die zur Berechnung verwendeten Reaktionswärmen für die Wasserverdampfung, Carbonat-Entsäuerung und Oxidation des TOC angegeben.
3 Durchgeführte Untersuchungen
3.1 Verwendete Rohmaterialien
Im Rahmen dieses Beitrags wurde sich auf eine Dachziegel-Betriebsmischung BM R ohne Carbonate und Organik beschränkt. Als Zusatzstoffe kamen Kalksteinmehl Calcit C, Sägemehl Holz H und Kohle K sowie deren möglichen Kombinationen mit jeweils einem praxisrelevanten Gehalt zum Einsatz. Die Zusammensetzung der Mischungen zeigt »Tabelle 3.
Folgende Eigenschaften der Rohmaterialien wurden bestimmt:
Betriebsmasse: Mineralbestand, Körnung, Glühverlust, TOC, TIC und Rohstoffenthalpie
Calcit: Mineralbestand, Körnung, Glühverlust und Rohstoff-enthalpie
Mischungen: Körnung, Glühverlust und Rohstoffenthalpie
Holz und Kohle: Elementaranalyse (chemische Elemente C, H, N, O und S), Aschegehalt, Heiz- und Brennwert
3.2 Eingesetzte Messmethoden
Zur Herstellung von Probekörpern wurde die trockene Betriebsmischung in einer Hammermühle auf eine Korngröße unter 2 mm zerkleinert und die Kohle auf eine Korngröße kleiner 1 mm gesiebt. Zum Einsatz kamen ausschließlich bei 110 °C bis zur Massekonstanz vorgetrocknete Materialien. Das Mischen erfolgte zunächst trocken in einem Zwangsmischer, danach mit dem erforderlichen Wasserbedarf. Die Probekörper mit den Abmessungen B x H x L = 40 x 40 x 40 bzw. 140 mm wurden im Labor-Extruder mit Vakuum hergestellt und danach zur Bestimmung des Mineralbestandes, der Körnung sowie der Rohstoffenthalpie Proben entnommen. An den Probekörpern wurden zudem die keram-technologischen Eigenschaften nach dem Trocknen und Brennen bis 1.000 °C bestimmt sowie kombinierte DTA-Gasaustreibungs-Messungen durchgeführt, auf die an dieser Stelle jedoch nicht näher eingegangen wird.
Folgende Messmethoden kamen zum Einsatz:
Mineralbestand: quantitative Röntgenanalyse, Tonminerale mit 3-facher Pulver-Analyse mittels XRD Stadi MP
Thermoanalyse: STA 449 F3 Jupiter Fa. Netzsch, Probemasse 40 mg, Aufheizrate 10 K/min
Körnung: Trockensieben mit den Maschenweiten 2.000 / 1.000 / 500 / 250 / 100 / 63 µm, < 32 µm mittels Sedigraph 5120 II Micromeritics
Glühverlust bis 1.000 °C: gravimetrisch
Kohlenstoffgehalt: Kohlenstoff gesamt TC sowie anorganischer Kohlenstoff TIC nach DIN ISO 10694, organischer Kohlenstoff TOC = TC - TIC
Kalorimeter: Brennwert nach [14], [15] bei 25 °C, adiabatisches Kalorimeter C4000 Fa. IKA
Brennstoffanalyse: Elementaranalyse DIN 51724-3, DIN 51727, DIN 51732, DIN 51733, Brennwert und Heizwert nach [15] und -3 bei 22 °C, adiabatisches Kalorimeter C6000 mit Kalorimeterbombe C6012 Fa. IKA, Aschegehalt DIN 51719, Wassergehalt DIN 51718
3.3 Ermittlung der Rohstoffenthalpie
Die unter Punkt 2 genannten Methoden kamen bei allen Mischungen zur Anwendung. Die Messung der DSC- und TG-Kurven sowie die Bestimmung des Mineralbestandes mittels XRD der Rohstoffe und Mischungen erfolgten an einem auf Tonminerale spezialisierten Institut. Die Rohstoffenthalpien wurden aus den Messwerten der TG und des Mineralbestandes sowie vereinfacht wie unter Punkt 2.2 und 2.4 beschrieben berechnet.
Unter Verwendung eines Kalorimeters ermittelte ein weiteres Institut, welches auf grobkeramische Untersuchungen spezialisiert ist, die Brennwerte der Rohstoffmischungen. Dazu wurde das Rohmaterial bei 55 °C bis zur Massekonstanz getrocknet und der Brennwert Ho,v als Mittelwert aus 3 Einzelmessungen bestimmt. Den Heizwert Hu berechneten die Autoren aus den Kalorimeter-Brennwerten und den in der Elementaranalyse bestimmten Gehalten an Wasserstoff H, Stickstoff N und Sauerstoff O sowie den ermittelten Wassergehalten aus der TG (Abspaltung des Wassers aus Tonmineralen, Hydroxiden) gemäß Gl. 3. Die Brenn- und Heizwerte von Holz und Kohle wurden an einem auf Brennstoffe spezialisierten, akkreditierten Institut gemäß Punkt 3.2 gemessen.

![»1 Vergleich der Rohstoffenthalpien dHR aus Thermoanalyse-Messungen (DSC) mit berechneten Werten aus Mineralbestand (XRD) und Masseverlust (TG), 33 Datensätze, TOC-Gehalt ≤ 0,10 M.-%, Calcit ≤ 22 M.-%, Dolomit ≤ 28 M.-% [6]](https://www.zi-online.info/imgs/1/6/8/5/9/1/1/tok_98cda42c6197f2804d7013535e29c989/w300_h200_x376_y226_FA_Lingl_Abb.1-9cb9fd4b357ed280.jpeg)
![»2 Vergleich der Rohstoffenthalpien dHR aus Thermoanalyse-Messungen (DSC) mit berechneten Werten aus Mineralbestand (XRD) und Masseverlust (TG), 128 Datensätze, TOC-Gehalt ≤ 3,17 M.-%, Calcit ≤ 22 M.-%, Dolomit ≤ 28 M.-% [6]](https://www.zi-online.info/imgs/1/6/8/5/9/1/1/tok_4f8131c5a993aea922412e53ac7cd6eb/w300_h200_x376_y225_FA_Lingl_Abb.2-78c68c73b4dda952.jpeg)