Rohstoffenthalpie grobkeramischer Rohstoffe (Teil 2)
Die Rohstoffenthalpie dHR hat einen wesentlichen Einfluss auf die energetische Bilanzierung von Tunnelöfen in der grobkeramischen Industrie und kann bis zu 30 % des gesamten Energieverbrauchs eines Ofens betragen bzw. bis zu 90 % des gesamten Energiebedarfs decken. Derzeit werden unterschiedliche Methoden genutzt, um die Rohstoffenthalpie zu ermitteln. Bei Tonrohstoffen, die keine Carbonate bzw. organische Bestandteile enthalten, stimmen gemessene und berechnete Werte mit Abweichungen von maximal ±100 kJ/kg vergleichsweise gut überein. Liegen jedoch Rohstoffe mit hohen Carbonat- und Organikgehalten vor, unterscheiden sich die Ergebnisse der unterschiedlichen Bestimmungsmethoden erheblich voneinander. Bisher ist nicht bekannt, welche Bestimmungsmethode tatsächlich praxisrelevante Werte liefert. Inhalt des Beitrages sind vergleichende Untersuchungen zur Rohstoffenthalpie an bekannten Rohstoffen. Die unterschiedlichen Bestimmungsmethoden (Dynamische Differenzkalorimetrie, Thermogravimetrie, Kalorimeter, Berechnung aus dem Mineralbestand sowie aus den Gehalten an Wasser, Carbonaten und organischen Bestandteilen) werden vorgestellt und anhand der Ergebnisse Unterschiede, mögliche Einsatzgrenzen und Fehlerquellen der Methoden diskutiert. Lesen Sie hier Teil 2 (Teil 1 in ZI 4/2021).
4 Ergebnisse und Diskussion
4.1 Eigenschaften der Rohstoffe
Die Eigenschaften der verwendeten Rohmaterialien zeigen die »Tabellen 4, 5 und 6.
4.2 Ermittelte Rohstoffenthalpien
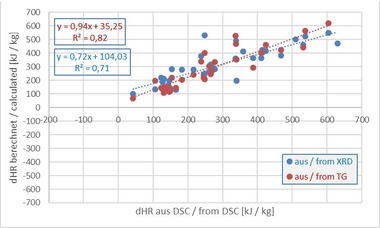
Die gemessenen und berechneten Rohstoffenthalpien der untersuchten Mischungen zeigt »Tabelle 7. Zur Veranschaulichung der starken Streuung der einzelnen Werte wurden der Mittelwert und die Standardabweichung von den Ergebnissen aller fünf Methoden berechnet.
Die Ergebnisse zeigen, dass die im Kalorimeter bestimmten Rohstoffenthalpien mit Ausnahme der kohlehaltigen Mischungen BM R-K und BM R-CK erheblich größer als die mit anderen Methoden ermittelten Enthalpien sind (Betrachtung der Werte hier zusammen mit dem jeweiligen Vorzeichen, vgl. »3 und »4). Bei der Mischung BM R-K ist der im Kalorimeter bestimmte Wert wesentlich kleiner als die anderen Messwerte. Hingegen hat der Kalorimeterwert der Mischung BM R-CK die gleiche Größenordnung wie die anderen Werte. Aus diesem Grund werden im Folgenden die jeweils überproportionalen Werte jeder Messreihe separat betrachtet.
»Tabelle 7 sowie »3 und »4 enthalten die Ergebnisse der selben DSC-Messung, die jedoch von unterschiedlichen Bearbeitern ausgewertet wurde. Bearbeiter I hatte keine Kenntnis der Mischungszusammensetzung. Bearbeiter II hingegen kannte sowohl die Komponenten als auch die Anteile in den Mischungen. Da in der Praxis eines Prüflabores die Zusammensetzung der Rohmaterialien meist nicht bekannt ist, werden im Folgenden lediglich die Ergebnisse von Bearbeiter I betrachtet.
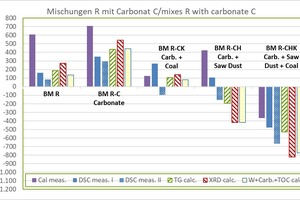
»3 zeigt die ermittelten Rohstoffenthalpien der Carbonat-haltigen Mischungen im Vergleich zur Ausgangsmischung BM R. Die verwendeten Abkürzungen entsprechen »Tabelle 7.
Ergebnisse BM R:
die dHR vom KAL beträgt +610 kJ/kg und ist vergleichsweise groß
die dHRohne KAL liegt zwischen +136 und +271 kJ/kg (Mittelwert +189 ±51 kJ/kg), dabei kleinster Wert aus WCC und größter Wert aus XRD
Ergebnisse BM R-C:
die dHR vom KAL beträgt +708 kJ/kg und ist vergleichsweise groß
die dHRohne KAL liegt zwischen +351 und +543 kJ/kg (Mittelwert +443 ±68 kJ/kg), dabei kleinster Wert aus DSC und größer Wert aus XRD
Ergebnisse BM R-CK:
die dHR der DSC beträgt +268 kJ/kg und ist vergleichsweise groß
die dHRohne DSC liegt zwischen +81 und +139 kJ/kg (Mittelwert +112 ±22 kJ/kg), dabei kleinster Wert aus WCC und größter Wert aus XRD
Ergebnisse BM R-CH:
die dHR von DSC und KAL ist positiv (endotherm) und vergleichsweise groß, die dHR der DSC beträgt +107 kJ/kg und
die dHR vom KAL beträgt +424 kJ/kg die dHRohne DSC und KAL ist negativ (exotherm) und liegt zwischen -420 und -193 (Mittelwert -344 ±107 kJ/kg), dabei kleinster Wert aus WCC und größter Wert aus TG
Ergebnisse BM R-CHK:
alle Werte sind negativ (exotherm) und streuen vergleichsweise stark
die dHR liegt zwischen -823 und -369 kJ/kg (Mittelwert -597 ±178 kJ/kg),
kleinster Wert aus XRD und größter Wert mit KAL
die dHR vom KAL beträgt -369 kJ/kg und ist noch vergleichsweise groß
die dHRohne KAL liegt zwischen -823 und -477 kJ/kg (Mittelwert -651 ±150 kJ/kg)
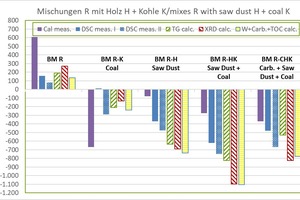
»4 zeigt die ermittelten Rohstoffenthalpien der Organik-haltigen Mischungen im Vergleich zur Ausgangsmischung BM R.
Ergebnisse BM R-K:
die dHR vom KAL beträgt -669 kJ/kg und ist vergleichsweise klein
die dHRohne KAL liegt zwischen -240 und +12 kJ/kg (Mittelwert -143 ±97 kJ/kg), dabei kleinster Wert aus WCC und größter Wert aus DSC
Ergebnisse BM R-H:
die dHR vom KAL beträgt -78 kJ/kg und ist vergleichsweise groß
die dHRohne KAL liegt zwischen -735 und -369 kJ/kg (Mittelwert -607 ±142 kJ/kg), dabei kleinster Wert aus WCC und größter Wert aus DSC
Ergebnisse BM R-HK:
die dHR vom KAL beträgt -276 kJ/kg und ist vergleichsweise groß
die dHRohne KAL liegt zwischen -1.103 und -621 kJ/kg (Mittelwert -911 ±201 kJ/kg), dabei kleinster Wert aus WCC und größter Wert aus DSC
Ergebnisse BM R-CHK:
alle Werte sind negativ (exotherm) und streuen vergleichsweise stark
die dHR liegt zwischen -823 und -369 kJ/kg (Mittelwert -597 ±178 kJ/kg),
kleinster Wert aus XRD und größter Wert mit KAL
die dHR vom KAL beträgt -369 kJ/kg und ist noch vergleichsweise groß
die dHRohne KAL liegt zwischen -823 und -477 kJ/kg (Mittelwert -651 ±150 kJ/kg)
4.3 Diskussion
Die von Bearbeiter I ausgewertete DSC liefert Rohstoffenthalpien, die sich mit Ausnahme der reinen Dachziegelmischung BM R von den Ergebnissen der Berechnungsmethoden wie auch vom Kalorimeter teilweise stark unterscheiden. Bei den Organik-haltigen Mischungen sind die Enthalpien aus der DSC I deutlich größer als die berechneten Werte. Mit Ausnahme der kohlehaltigen Mischungen BM R-K und BM R-CK sind die Ergebnisse jedoch kleiner als die Kalorimeter-Werte. Die Rohstoffenthalpien der von Bearbeiter II ausgewerteten DSC sind durchweg kleiner als bei Bearbeiter I. Bei den Mischungen sind - mit Ausnahme der kohlehaltigen Mischung BM R-CK - die Enthalpien aus der DSC II ähnlich den berechneten Werten. Alle Ergebnisse sind kleiner als die Kalorimeter-Werte. Die Ergebnisse zeigen, dass die im Kalorimeter bestimmten Rohstoffenthalpien mit Ausnahme der beiden Kohlemischungen BM R-K und BM R-CK wesentlich größer sind als bei den anderen Methoden. Die drei Berechnungsmethoden liefern Rohstoffenthalpien, die annähernd die gleiche Größenordnung aufweisen. Dies ist nicht verwunderlich, da diese Methoden von denselben theoretischen Annahmen hinsichtlich Entwässerung, Decarbonatisierung und Oxidation ausgehen. Bei der vereinfachten WCC-Berechnung wurden meist kleinere Enthalpien als mit der Berechnung aus XRD oder TG ermittelt. Da sich die gezeigten Ergebnisse insbesondere bei der Kombination von Carbonaten und Organik z. T. erheblich unterscheiden und offenbleibt, welche Methode letztendlich ein „korrektes“ Ergebnis liefert, werden im Folgenden mögliche Fehlerquellen diskutiert.
4.3.1 Probenahme, TOC-Bestimmung
Für den Ergebnisvergleich der verwendeten Mess- und Berechnungsmethoden ist eine repräsentative Probenahme von entscheidender Bedeutung. Grobkeramische Rohstoffe sind dem Namen nach grob, das heißt in sich inhomogen. So können bereits in der Tongrube bzw. bei der Probenahme große Unterschiede in der Rohmaterialzusammensetzung vorliegen und einzelne Partikel wie z. B. Kalkknollen, faserige organische Bestandteile oder Tonlunker nicht den gesamten Rohstoff repräsentieren. Es konnte gezeigt werden, dass sich insbesondere kleine Änderungen des TOC- bzw. Carbonatgehaltes überproportional auf die gesamte Rohstoffenthalpie auswirken. Für die Untersuchungen wurde daher homogenisiertes Probenmaterial verwendet, wie unter Punkt 3.2 beschrieben.
4.3.2 Thermoanalyse DSC, TG
Die temperaturaufgelöste Thermoanalyse macht als einzige der hier vorgestellten Methoden die auftretenden Reaktionen während des Erwärmens sichtbar. Die Bestimmung der Rohstoffenthalpie mit Hilfe der DSC sowie der TG ist von folgenden Faktoren abhängig, die das Ergebnis wesentlich beeinflussen:
Die verwendete Probemenge ist gering, damit für grobkeramische Rohstoffe wenig repräsentativ und stellt hohe Anforderungen an die Probenahme.
Abhängig von dem Gerät, der Probenpräparation, der Probemenge und Körnung sowie der Aufheizrate treten die Reaktionen in der Thermoanalyse bei anderen Temperaturen als im realen Brennprozess auf. So können sich die Reaktionen, die in der Thermoanalyse nacheinander ablaufen, im realen Brennprozess überlagern und gegenseitig behindern wie z. B. Entgasungen und Oxidationen. Inwiefern sich das auf die daraus resultierende Rohstoffenthalpie auswirkt, ist nicht bekannt.
Die Messungen erfolgen meist bis 1.050 °C. Höhere Temperaturen und die Mineralneu- bzw. Schmelzphasenbildung werden dabei nicht berücksichtigt. Abhängig vom Brennregime können sich neue Mineralphasen sowie Schmelzen bilden, die zusätzlich Wärme freisetzen oder verbrauchen. Diese Phänomene sind ebenfalls von der Probenpräparation, der Probemenge und Körnung sowie der Aufheizrate abhängig.
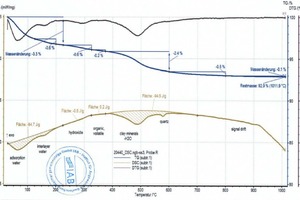
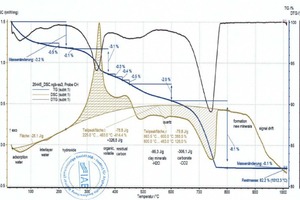
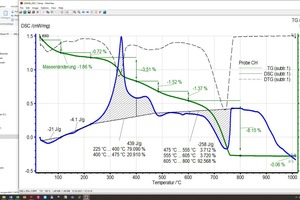
Beim Erhitzen ändern sich wesentliche thermophysikalische Eigenschaften der Probe (Masse, Wärmekapazität, Wärmeleitfähigkeit, Porosität und damit die Gasdurchlässigkeit). Dadurch tritt eine Verschiebung der Basislinie auf. Diese ist umso stärker, je größer die Reaktionen im Material sind. Das bedeutet, dass die Basislinie reiner Tone von der eines Tones mit Carbonaten bzw. Organik abweicht und damit mehr oder weniger subjektiv festgelegt werden muss. Dies zeigen die zwei Diagramme (»5) für die Mischungen BM R und BM R-C (fette beige Kurven und Peakflächen). Beide Mischungen unterscheiden sich lediglich durch die Anteile an der Mischung BM R und an Carbonat (vgl. »Tabelle 3). Die Basislinien, jeweils als dünne, beige Linien oberhalb der schraffierten Flächen zu sehen, sind bis 600 °C nahezu identisch. Oberhalb von 600 °C kommt es bei der Mischung BM R-C zur Entsäuerung der Carbonate und die Basislinie unterscheidet sich deutlich von der Mischung BM R.
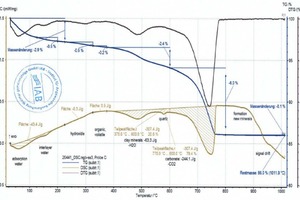
Die Rohstoffenthalpie wird aus den Peakflächen der Einzelreaktionen berechnet. Für die Definition dieser Flächen legt der Bearbeiter die Temperaturbereiche fest, in denen die einzelnen Reaktionen beginnen und enden. Die TG-Kurve sowie Softwaretools erleichtern das Eingrenzen dieser Bereiche erheblich. Dennoch ist das Festlegen der Basislinie, die Kurvenauswahl für die Flächenbestimmung sowie die Bestimmung von Beginn und Ende einer Reaktion stets vom Wissensstand des Bearbeiters und seiner Kenntnis zur Materialzusammensetzung abhängig, insbesondere dann, wenn überlagerte Reaktionen wie beim organischen Ausbrand oder der Carbonat- und Tonmineralzersetzung auftreten. Dies zeigen die Diagramme (»6) für die Mischung BM R-CH nach Auswertung durch die unterschiedlichen Bearbeiter. Die Rohstoffenthalpien unterscheiden sich in diesem Beispiel um 263 kJ/kg.
Beim Auftreten mehrerer überlagerter exo- und endothermer Reaktionen hängt die summarische Rohstoffenthalpie davon ab, ob die Basislinie im Diagramm weiter oben (Erhöhung exothermer und Verringerung endothermer Anteil) oder weiter unten (Erhöhung endothermer und Verringerung exothermer Anteil) festgelegt wird. Auch die Auswertung der Reaktionen – einzeln oder zusammengefasst – beeinflusst die summarischen Rohstoffenthalpien. Selbst bei genauer Kenntnis der Materialzusammensetzung ist somit keine 100 %-ig sichere Auswertung möglich und das Ergebnis lediglich als Größenordnung anzusehen. Abhilfe kann hier eine aufwändige Kalibrierung der DSC mit demselben, in einzelnen Temperaturschritten vorgebrannten Material schaffen (z. B. in 100 °C-Schritten).
4.3.3. Kalorimeter
Die Bestimmung der Rohstoffenthalpie mit Hilfe eines Kalorimeters ist von folgenden Faktoren abhängig, die das Ergebnis wesentlich beeinflussen:
Das Kalorimeter liefert einen summarischen Messwert, der die energetische Veränderung des Materials vom Anfangs- zum Endzustand nach einer vollständigen Verbrennung der zugegebenen Hilfsstoffe sowie der Organik im Material beschreibt. Einzelne Reaktionen wie bei der Thermoanalyse werden nicht detektiert. Durch Abzug des Brennwertes der eingesetzten Hilfsstoffe und unter Berücksichtigung der Wärmekapazität des Gerätes wird der Brennwert des Materials berechnet. Infolge der vollständigen Verbrennung der Benzoesäure und der Brennhilfsmittel kann das keramische Probematerial schmelzen (Schmelzenthalpie). Zudem sind bei erhöhten Temperaturen und hohem Druck Mineralneubildungen möglich (Mineralbildungsenthalpie). Diese Enthalpien sind neben den in »Tabelle 1 aufgeführten Werten zusätzlich im Messwert enthalten und nicht bekannt. Nach [32] ist der ermittelte Brennwert aufgrund der im Vergleich zum normalen Brennprozess erheblich größeren Sinter- und Verglasungsreaktionen um 21 bis 42 kJ/kg zu niedrig.
Der ermittelte Brennwert wird in den Heizwert umgerechnet. Die in der Mischung vorliegenden erforderlichen Gehalte an den chemischen Elementen H, C, O, N, S wurden in dieser Arbeit nicht gemessen, sondern lediglich aus den Bestandteilen von Holz und Kohle berechnet. Der damit einhergehende Fehler bei der Umrechnung auf den Heizwert wird aufgrund der geringen Mengen an H, C, O, N und S in der reinen Betriebsmischung BM R jedoch als gering eingeschätzt.
In der Literatur werden häufig Brennwerte Ho aus dem Kalorimeter mit Rohstoffenthalpien (berechnet oder mittels DSC gemessen) bzw. den Heizwerten Hu gleichgesetzt. Dies führt zu Fehlannahmen für den Brennprozess, da hier lediglich der Heizwert genutzt werden kann bzw. die entsprechende Wärme aufgebracht werden muss. Für die untersuchten Mischungen beträgt die Differenz aus Hu und Ho 142 bis 217 kJ/kg. Bei Holz und Kohle ohne Ton beträgt die Differenz bereits 1.110 bis 1.370 kJ/kg.
Das Kalorimeter wurde zur Bestimmung der Brennwerte von Brennstoffen entwickelt. Dieser Wert ist als Absolutwert um ein bis zwei Größenordnungen größer als die Rohstoffenthalpie grobkeramischer Rohstoffe. Um die geringen Enthalpien grobkeramischer Rohstoffe im Kalorimeter zu detektieren, wird zur Materialprobe Benzoesäure zugegeben. Werden die Mengen an Materialprobe und Benzoesäure nebst Verbrennungshilfen und die zugehörigen Enthalpien, wie unter Punkt 2.3 beschrieben, ins Verhältnis gesetzt, fällt auf, dass eine Materialprobe mit beispielsweise -200 kJ/kg einen Anteil an der im Kalorimeter bestimmten Gesamtenthalpie von ca. 0,7 % hat, was zu einer Temperaturerhöhung von 0,019 K führt. Die Anteile der Brennhilfen an der Gesamtenthalpie betragen hingegen 66,6 % für die Benzoesäure, 26,5 % für das Tütchen und 6,1 % für den Zünddraht. Es scheint fraglich, ob das Messsystem diese geringen Werte korrekt erfassen kann (vgl. Wiederholstreubereich und Bestimmungsgrenze).
Die Messung im Kalorimeter erfolgt unter reiner Sauerstoffatmosphäre bei einem Druck von 30 bar und entspricht damit nicht den realen Bedingungen in einem Tunnelofen. Hier besteht ein geringer Unterdruck von wenigen Millibar und der Sauerstoffgehalt ist kleiner 21 %. Durch den hohen Druck im Kalorimeter können zudem die Reaktionen bei anderen Temperaturen stattfinden bzw. sich die Mengen der Reaktionsprodukte ändern.
4.3.4. Berechnung aus XRD, TG, WCC
Die Berechnung der Rohstoffenthalpie aus dem Mineralbestand birgt immanente Fehlermöglichkeiten, sodass die ermittelten Werte lediglich als Größenordnung verstanden werden können. Auf folgende Fehlerquellen sei explizit hingewiesen [21, 23]:
Bei der qualitativen und quantitativen Bestimmung der Tonminerale mittels XRD sind sowohl ausreichende Erfahrungen als auch standardisierte Vergleichsproben der reinen Minerale erforderlich. Daher können sich die Ergebnisse zum Mineralbestand von Labor zu Labor enorm unterscheiden und führen zu unterschiedlichen Ergebnissen der Rohstoffenthalpie.
Es können Unsicherheiten bei der mineralogischen Analyse der Ausgangsrohstoffe, Schwankungen in der Massezusammensetzung, Fehlerquellen bei den Analysengeräten sowie Unwägbarkeiten bei der Auswertemethodik nicht ausgeschlossen werden.
Die Mineralphasen insbesondere die Tonminerale können, obwohl zur gleichen Klasse gehörend, in der chemischen Zusammensetzung, den Schichtladungen im Fehlordnungsgrad und durch Gitterdeformationen in ihren Reaktionswärmen von den in der Literatur angegebenen Werten für dHi abweichen.
Der Einfluss von Temperatur, Zeit und Kornaufbau sowie der unterschiedliche Reaktionsablauf und mögliche Unterschiede der Wärmetönung unter hydrothermalen, reduzierenden und oxidierenden Bedingungen sind nicht oder nur unvollständig bekannt. Der Atmosphäreneinfluss findet keine Berücksichtigung.
Wechselwirkungen der Minerale sowie Überlagerungen von Reaktionen können aufgrund des Vielstoffsystems in grobkeramischen Rohstoffen nicht einbezogen werden.
Sinterreaktionen und Mineralneubildungen wurden in der Grobkeramik aufgrund des Nichteinstellens von Gleichgewichten bei einer kurzen Brennzeit, großen Massedurchsätzen bzw. geringen Brenntemperaturen weit unter dem Sinterpunkt bisher vernachlässigt. Sie sollten jedoch bei langen Brennzeiten, bei Brenntemperaturen > 1.000 °C sowie geringen Kühlgeschwindigkeiten berücksichtigt werden.
Die bei den Berechnungen verwendeten Werte für dHi sind der Literatur entnommen. Bestimmungsmethoden und -bedingungen sind nicht bekannt und eine Reproduzierbarkeit auf die Bedingungen des grobkeramischen Brandes ist nicht nachgewiesen.
Die Erfahrungswerte zur Berechnung der Rohstoffenthalpie aus den temperaturaufgelösten Masseverlusten (TG-Kurve) beruhen auf Messwerten aus der Thermoanalyse. Diese Messergebnisse können durch die subjektive Eingrenzung der Reaktionen fehlerbehaftet sein (siehe Fehlerbetrachtung DSC).
5 Fazit und Ausblick
Die derzeit angewendeten Methoden zur Ermittlung der Rohstoffenthalpie dHR von grobkeramischen Rohstoffen sind eingehend beschrieben. Am Beispiel einer Dachziegelmasse, der Kalkmehl, Sägespäne und Kohle zugesetzt war, wurden die Methoden angewendet und die Ergebnisse gegenübergestellt.
Es zeigte sich, dass
jede Methode grundlegende Fehlerquellen aufweist, die sich je nach Methode stark voneinander unterscheiden.
nicht festgestellt werden konnte, welche der verwendeten Methoden für den Brennprozess im Tunnelofen „korrekte“ Ergebnisse liefert.
eine Vergleichbarkeit der Ergebnisse unterschiedlicher Methoden aus diesen Gründen lediglich begrenzt möglich ist.
die vereinfachte Berechnung aus den Gehalten an Kristallwasser, Carbonaten und TOC wie auch die Berechnung aus den temperaturaufgelösten Masseverlusten der TG für die untersuchten Materialien ähnliche Werte liefert wie die aufwändigere Berechnung aus den einzelnen Mineralen.
zwischen den Kalorimeter-Werten und den mit anderen Methoden ermittelten Werten die größten Unterschiede liegen.
sich die Werte vom Kalorimeter für die Mischungen mit Holz und Kohle nicht addieren, wie zu erwarten gewesen wäre und wie es bei den anderen Methoden festgestellt wurde.
der Unterschied zwischen Ho und Hu für die untersuchten Mischungen im Kalorimeter vergleichsweise groß ist. Das Mess-ergebnis (Brennwert Ho) ist auf den Heizwert Hu umzurechnen. Hierfür müssen die Gehalte an Wasserstoff, Stickstoff und Sauerstoff vorliegen, die bisher erfahrungsgemäß nicht bestimmt werden.
sich die bisherigen Erfahrungen bestätigen, dass in Anwesenheit von Kohle, Holz und Carbonaten die berechneten und gemessenen Rohstoffenthalpien stärker voneinander abweichen als bei Carbonat- und Organik-armen Rohstoffen.
bereits geringe Mengen an organischem Kohlenstoff, die bei HMz zur Porosierung und zur Verringerung des Energieverbrauches und bei VMz zur Farbgebung üblicherweise zugegeben werden, die Ergebnisse der unterschiedlichen Methoden wesentlich stärker beeinflussen als die Carbonat-Entsäuerung und die Tonmineralreaktionen.
bei der Auswertung von DSC-Messungen die Kenntnis der stofflichen Zusammensetzung andere Ergebnisse liefert kann als deren Nicht-Kenntnis.
Die Untersuchungen waren bis auf die Messung im Kalorimeter Einzelmessungen. Dies ist trotz großer Schwankungen in der Zusammensetzung grobkeramischer Rohstoffe übliche Praxis. Für weiterführende Arbeiten ist zu empfehlen, die festgestellten Ergebnisse zu verifizieren sowie mit anderen Rohstoffen untersetzen. Die Ergebnisse lassen somit genügend Raum für zukünftige Arbeiten. Die Frage, welche Methode mit welchen Rohstoffen korrekte Werte liefert, bedarf somit weiterer systematischer Untersuchungen.